南京华讯知识产权有限公司 电子报 2024 年12月 第891期
发布时间:
2025-01-03 14:36
南京华讯知识产权有限公司 电子报 2024 年12月 第891期
 创办人的话
创办人的话
各位客户朋友们大家好!
您认为专利审查是完全客观的的吗?也就是,专利在审查过程中,有没有标准作业流程?只要照表操课,所有审查员都可以且应该得到一致的结论呢? 我个人认为答案是否定的,因为专利本质上是透过法律文字所包装出来的权利,而法律有无法绝对精确以及绝对客观的本质。特别是,熟悉专利的人都知道,在专利审查过程中要考量进步性的问题,也就是专利与现有技术的差异是不是足够大? 这问题与其说是真假的问题,还不如说是价值判断的问题,也就是收到审查员个人对技术的认知判断影响很大。
专利的这种带有主观的特性往往造成专利代理人与发明人间的矛盾,因为发明人是工程师或科学家,他们受的训练是完全客观的,他们不容易接受专利竟然会带有主观成分。要如何解决这矛盾? 除了普及知识产权知识外,专利代理人与发明人间的沟通是非常重要的。而这就是我们华讯多年来推动专利服务顾问化的原因。
侯庆辰
2024/11/24
本期焦点
- 专利新闻专题解析
- 辉瑞的PARP抑制剂「他拉唑帕利」在中国获批上市
- 阿美替尼递交第五项新适应症上市申请
- 授权方能否授予对未来续案专利的许可,使该专利最终核发给第三方?
美国地方法院给出肯定答复
- 学名药厂与专利药厂之民事诉讼笔记
- 辉瑞的PARP抑制剂「他拉唑帕利」在中国获批上市
2024年11月5日,国家药品监督管理局(NMPA)官网显示,辉瑞的甲苯磺酸他拉唑帕利胶囊(talazoparib,商品名为泰泽纳®)的上市申请已获得批准。作为中国目前唯一获批HRR基因突变的mCRPC治疗的PARP抑制剂,泰泽纳®(Talzenna®)将助力中国前列腺癌精准诊疗突破,惠及中国前列腺癌患者。

|
|
他拉唑帕利是聚腺苷二磷酸核糖聚合酶(PARP)抑制剂,包括PARP1和PARP2。体外研究表明,对于DNA修复基因缺陷(包括BRCA1 和BRCA2)的肿瘤细胞系,基于合成致死(Synthetic Lethality)原理,他拉唑帕利可能通过抑制PARP酶活性和促进PARP-DNA复合物的形成来发挥细胞毒作用,从而导致肿瘤细胞DNA损伤、抑制肿瘤细胞的增殖并促进肿瘤细胞凋亡。

他拉唑帕利最早由BioMarin开发,2015年Medivation从BioMarin收购了该药物,2016年辉瑞以140亿美元收购Medivation公司,自此他拉唑帕利归属辉瑞。2018年,美国食品药品监督管理局(FDA)批准他拉唑帕利治疗胚系突变BRCA1/2(gBRCAm)的HER2阴性局部晚期或转移性乳腺癌;2023年6月, FDA批准泰泽纳®联合恩扎卢胺用于同源重组修复(HRR)基因突变的转移性去势抵抗性前列腺癌(mCRPC)成人患者的治疗。2024年1月,欧洲药品管理局(EMA)批准泰泽纳®与恩扎卢胺联用治疗无临床化疗指征的mCRPC成人患者。
针对他拉唑帕利、辉瑞目前在中国上市药品专利信息登记平台链接有3件专利:200980139634.2(授权公告号为CN102171214B,届满日是2029-07-26,母案)、201410640197.5(授权公告号为CN104478875B,届满日是2029-07-26,分案)、201180062085.0(授权公告号为CN103282365B,届满日是2031-10-19),可见辉瑞对他拉唑帕利的布局的专利保护比较全面,则仿制药企想突破其专利保护在中国进行仿制具有一定难度。
此前,国内已有奥拉帕利(阿斯利康)、氟唑帕利(恒瑞)、尼拉帕利(GSK/再鼎)、帕米帕利(百济)这4款PARP抑制剂获批上市,以及强生的尼拉帕利醋酸阿比特龙复方(Akeega®)也已获批上市。另外还有一款PARP抑制剂塞纳帕利(senaparib,英派药业/华东医药)已申报上市,正在审评当中。
参考文献:
1.https://bydrug.pharmcube.com/news/detail/024d98ee38bfe92a363f76f7c3579548
2.https://news.qq.com/rain/a/20241105A060AP00
3.https://mp.weixin.qq.com/s/aXgek2W3Eb6PLopImFmb7Q
4.https://news.sina.com.cn/sx/2024-11-05/detail-incuzhax4304102.shtml
by 智财研究部
- 阿美替尼递交第五项新适应症上市申请
近年来,翰森制药自主研发的第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)甲磺酸阿美替尼片在非小细胞肺癌(NSCLC)治疗领域持续取得突破。11月27日,中国国家药品监督管理局药品审评中心(CDE)官网显示,翰森制药为阿美替尼提交了一项新适应症上市申请,可能用于联合化疗治疗EGFR突变晚期肺癌。这是阿美替尼在国内递交的第5项新药申请(NDA)。
阿美替尼作为国内首个原创的第三代EGFR-TKI,自2020年3月获批二线治疗EGFR T790M突变阳性局部晚期或转移性NSCLC以来,已实现多次适应症拓展。2021年,阿美替尼获批一线治疗EGFR外显子19缺失或外显子21(L858R)置换突变的局部晚期或转移性NSCLC成人患者;2023年,其第三项适应症获CDE受理,用于肿瘤切除术后EGFR敏感突变的辅助治疗。此外,第四项适应症用于含铂根治性放化疗后未出现疾病进展的不可切除局部晚期EGFR敏感突变NSCLC患者,目前已被纳入突破性治疗品种并优先审评,预计将于明年获批。
在最新适应症方面,阿美替尼的Ⅲ期注册试验AENEAS2数据显示,与单纯化疗相比,阿美替尼联合化疗显著延长了局部晚期或转移性EGFR突变NSCLC患者的无进展生存期(PFS)。研究结果显示,联合治疗使疾病进展或死亡风险降低超50%,中位PFS超过两年,且未发现新的安全性信号。这一突破进一步巩固了阿美替尼在EGFR突变肺癌治疗领域的重要地位。
除国内市场外,阿美替尼的国际化布局也取得积极进展。2022年12月,阿美替尼的上市许可申请获欧洲药品管理局(EMA)受理,涉及两项适应症:用于一线治疗EGFR敏感突变的局部晚期或转移性NSCLC患者,以及二线治疗EGFR T790M突变阳性患者。
EGFR突变是NSCLC最常见的基因异常之一。针对这一靶点的治疗手段近年来飞速发展,第三代EGFR-TKI因其卓越疗效和安全性,逐渐成为治疗的首选方案。作为该领域的国产创新药,阿美替尼不仅填补了国内技术空白,也凭借一系列研究数据在国际市场展现出竞争力。
据中国上市药品专利信息公开的信息,目前甲磺酸阿美替尼片登记了以下相关专利,未查询到仿制药专利声明。
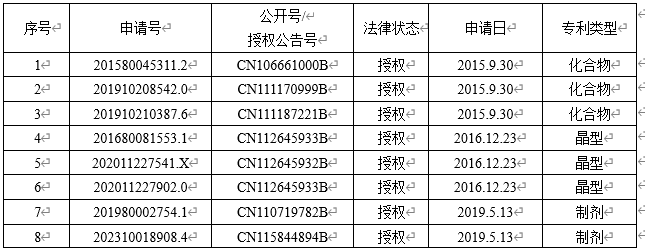
by 智财研究部
- 授權方能否授予對未來續案專利的許可,使該專利最終核發給第三方?美國地方法院給出肯定答覆
2024年11月7日,在一項具有里程碑意義的裁決中,美國特拉華州地方法院的Christopher J. Burke法官對以下問題給出了肯定答覆:授權方能否授予對未來續案專利的許可,使該專利最終核發給第三方? 這一備受歡迎的澄清出現在解決兩家製藥公司Horizon和Apotex之間專利侵權訴訟的過程中。
此次訴訟的核心是一份由Apotex與Nuvo Research Inc.(簡稱“Nuvo”)簽署的和解協議。該協議授予Apotex對某些專利的使用許可,這些專利與Nuvo的雙氯芬酸鈉外用溶液產品PENNSAID® 1.5% 有關。其中包括專利號8,252,838(簡稱“‘838專利”),該專利被明確授權給Apotex,以及「由其分案、續案、重發或複審而產生的任何專利」。此外,和解協議還授權Apotex生產和商業化PENNSAID® 2%(一種2%濃度的雙氯芬酸鈉外用產品)的仿製版本。
隨後,Nuvo為838專利提交了連續申請編號14/497,096(簡稱“‘096申請”)。在此之後,Nuvo與Horizon簽訂了一份資產購買協議,根據該協議,Horizon收購了PENNSAID® 2% 以及Nuvo的所有相關專利權。購買的資產中特別包括838專利和096申請。096申請後來被核准,並由Horizon持有,專利號為9,066,913(簡稱“913專利”)。
當Apotex推出其PENNSAID® 2% 的仿製版本時,Horizon提起侵權訴訟,聲稱Apotex侵犯了其913專利。因此,本案的核心問題在於確定Nuvo授予Apotex的許可範圍是否有效擴展至913專利。儘管該專利明確是838專利的續案專利,但其最終核准給了第三方。
對此,Burke法官裁定:「授權方可以選擇將許可範圍擴展至未來核准的續案專利,從而確保被授權方在未來對該續案專利不會遭遇訴訟——即使該續案專利最終核發給第三方」。他進一步指出,Apotex與Nuvo之間和解協議中使用的語言清楚表明,雙方的意圖是將許可範圍延伸至913專利。
換句話說,如果可範圍明確包括續案專利,這些專利最終核發給誰,則在考慮被授權人在這些專利下的權利時是無關緊要的。此裁決為制定專利許可協議提供了一項重要先例,尤其是在續案申請普遍存在的創新驅動型行業,例如製藥業。
参考资料:
伯克法官的備忘意見書Diclo_Opinion_11_7_22.pdf (2024年11月25日訪問)。
by 黄恺蜜 律师
- 学名药厂与专利药厂之民事诉讼笔记
本文透过分析五件近年的判决民事判决,观察到学名药厂在专利诉讼中采取的成功策略,以及法院对于医药专利有效性与侵权判断的思维脉络。
第一案例:109年度民专诉字第51号判决
本案的核心争议在于系争学名药是否落入原药厂专利请求项的文义或均等范围。原药厂主张其专利中的「水溶性纤维素醚或其酯」与学名药中的特定成分具有相同功能,但学名药厂则强调两者在结构上存在明显差异。同时,双方也就专利说明书的揭露充分性以及专利的新颖性和进步性展开攻防。
在本判决中,法院支持了学名药厂的立场,认定系争学名药未落入专利请求项的文义或均等范围。关键在于学名药厂成功证明其产品中的成分与专利中描述的物质在结构上确实存在明显差异,且原药厂未能证明这些成分能达到相同的抑制沉淀效果。更重要的,本判决中法院采纳先前技术阻却原则的抗辩,认为学名药的技术特征仅为单一先前技术与该领域通常知识的简单组合。
第二案例:110年度民专诉字第8号判决
这个案例聚焦于原药厂两项专利的有效性问题。双方就专利说明书的揭露充分性、新颖性,以及多项先前技术组合是否足以证明专利不具进步性展开辩论。特别是在进步性的争议上,原药厂强调其专利具有无法预期的技术效果。
本判决最终认定原药厂的两项专利均不具进步性。法院认为,虽然这些专利的说明书已充分揭露技术内容,且具有新颖性,但从先前技术的组合来看,专利所主张的技术特征对该领域技术人员而言是显而易见的。特别是原药厂未能提供充分证据支持其所主张的无法预期功效。
第三案例:111年度民专诉字第42号判决
本案涉及血压药物的专利争议,焦点在于将已知的血管紧缩素II受体拮抗剂替换为新型药物的技术是否具有进步性。原药厂强调其药物组合具有显著的降血压效果,但学名药厂则主张这样的效果是可预期的。
法院采纳了学名药厂的论点,认定原药厂专利不具进步性。法院指出,对于该领域技术人员而言,以新型药物替换已知药物是具有合理动机的技术选择,且原药厂所主张的降血压效果是可以预期的结果。法院特别强调,即使新型药物的疗效较佳,这种改良仍属于该领域技术人员的例行发展。
第四案例:111年度民专上字第6号判决
这个案例主要争议在于原药厂专利中有关药物晶型及高药剂载量制剂技术的进步性。原药厂强调其专利同时实现了热力学稳定性和机械应力稳定性,以及高药剂载量下的制剂特性,但学名药厂认为这些特性均为可预期。
法院支持学名药厂的立场,认为原药厂专利不具进步性。法院认定,原药厂所主张的各项技术特征,包括晶型的稳定性和高药剂载量的制剂特性,均为该领域技术人员依据先前技术所能轻易完成。法院特别指出,这些技术效果是可以透过常规的制程优化来达成的。
第五案例:112年度民专诉字第33号判决
本案的核心争议在于原药厂专利的进步性,以及商业成功是否能作为支持进步性的有效证据。原药厂强调其专利药品的商业成功证明了专利的价值,但学名药厂则质疑商业成功与专利技术特征之间的关联性。
法院认定原药厂专利不具进步性,并特别驳回了原药厂关于商业成功的主张。法院强调,商业成功与专利的技术特征之间并无直接关联,专利的进步性应当从技术层面进行判断。法院认为,基于先前技术的组合,该领域技术人员可以轻易完成系争专利的发明。
以上五件判决,反映出台湾法院在医药专利诉讼中的判断倾向。法院在进步性的认定上,较为重视客观的技术证据,而非仅依赖商业成功等间接证据。同时,法院对于原药厂主张的无法预期功效采取相对严格的审查标准,要求必须提供充分的实验数据支持。
从这些判决可以归纳出学名药厂成功的几个关键策略。在产品开发阶段就注意避开专利侵权的可能性,透过不同的化学结构或制程设计来规避专利范围。其次,在专利有效性的挑战上,学名药厂善于运用先前技术的组合来证明专利欠缺进步性,并且能够有效反驳原厂关于无法预期功效的主张。最后,学名药厂在诉讼过程中展现出扎实的技术论证能力,能够从药物化学、制剂技术等专业角度提出具说服力的论点。
综观这些判决,我们可以看到学名药厂如何在与专利药厂之间的民事诉讼中获得胜诉,不仅来自于充分的诉讼准备,更重要的是在产品研发阶段就已经开始布局,这些案例也为台湾医药专利诉讼的发展提供了重要的参考价值,有助于产业界更好地理解法院在相关案件中的判断标准。
by 智财研究部

