
NEWS
最新消息
国产奥司他韦首获FDA批准
- 分类:最新消息
- 作者:华讯知识产权
- 来源:
- 发布时间:2020-03-10 13:48
- 访问量:
【概要描述】美国FDA官网显示,东阳光药在美国FDA申报的抗流感药磷酸奥司他韦胶囊的新药简略申请(ANDA,即美国仿制药申请)已于当地时间3月4日获得批准,包括30mg、45mg、75mg三种规格。引人注目的是,这是国产磷酸奥司他韦制剂首次获得FDA批准在美国上市。流行性感冒是流感病毒引起的急性呼吸道感染,也是一种传染性强、传播速度快的疾病。典型的临床症状是:急起高热、全身疼痛、显著乏力和轻度呼吸道症状。本病
国产奥司他韦首获FDA批准
【概要描述】美国FDA官网显示,东阳光药在美国FDA申报的抗流感药磷酸奥司他韦胶囊的新药简略申请(ANDA,即美国仿制药申请)已于当地时间3月4日获得批准,包括30mg、45mg、75mg三种规格。引人注目的是,这是国产磷酸奥司他韦制剂首次获得FDA批准在美国上市。流行性感冒是流感病毒引起的急性呼吸道感染,也是一种传染性强、传播速度快的疾病。典型的临床症状是:急起高热、全身疼痛、显著乏力和轻度呼吸道症状。本病
- 分类:最新消息
- 作者:华讯知识产权
- 来源:
- 发布时间:2020-03-10 13:48
- 访问量:
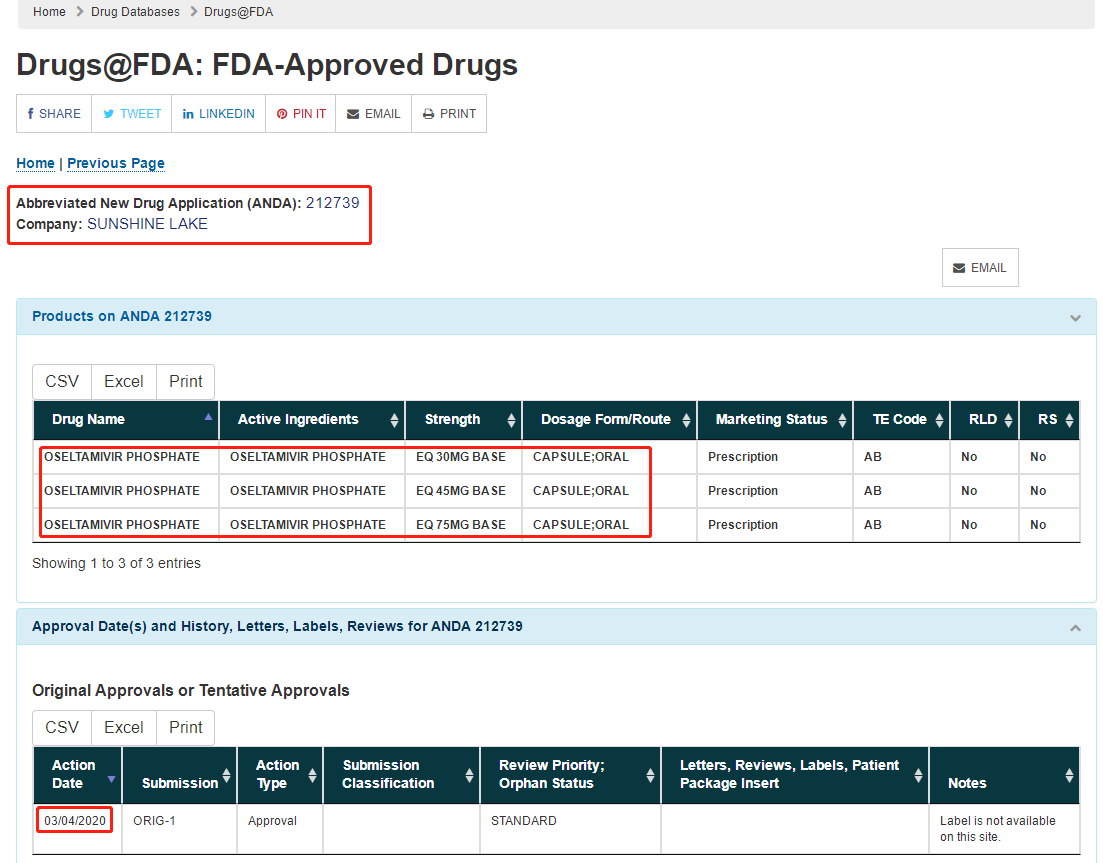
美国FDA官网显示,东阳光药在美国FDA申报的抗流感药磷酸奥司他韦胶囊的新药简略申请(ANDA,即美国仿制药申请)已于当地时间3月4日获得批准,包括30 mg、45 mg、75 mg三种规格。引人注目的是,这是国产磷酸奥司他韦制剂首次获得FDA批准在美国上市。
流行性感冒是流感病毒引起的急性呼吸道感染,也是一种传染性强、传播速度快的疾病。典型的临床症状是:急起高热、全身疼痛、显著乏力和轻度呼吸道症状。本病具有自限性,但在婴幼儿、老年人和存在心肺基础疾病的患者容易并发肺炎等严重并发症而导致死亡。根据WHO及柳叶刀的研究,全球每年大约有5%-10%的成年人和20%-30%的儿童罹患季节性流感,约300-5000万发展为重症病例,多达30-64.6万人死于季节性流感的呼吸系统疾病,我国每年感染流感的人数可达到0.65-2亿人。
奥司他韦是一款对由H5N1、H9N2等亚型流感病毒引起的流行性感冒有治疗和预防作用的神经氨酸酶抑制剂,由吉利德研发,并由罗氏进行全球商业化。该药于1999年10月首次在瑞典推出,随后进入加拿大、欧盟和美国市场,2002年获准进入中国。奥司他韦主要适应症包括用于成人和1岁及1岁以上儿童的甲型和乙型流感治疗、用于成人和13岁及13岁以上青少年的甲型和乙型流感预防。奥司他韦的总体安全性良好,耐药率低。2009年WHO推荐奥司他韦为“基本药物(Essential medicine)”,美国和欧洲CDC也相继将其推荐为主要的抗流感病毒药物。鉴于较高的安全性,奥司他韦还是FDA批准的唯一一个可用于超过14天新生儿流感治疗药物。
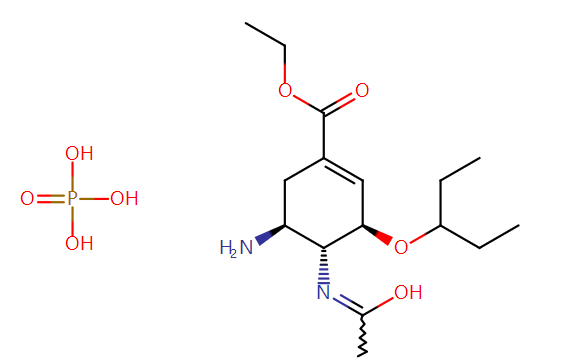
磷酸奥司他韦化学式:C16H28N2O4·H3PO4
化学名称:(3R,4R,5S)-4-乙酰氨基-5-氨基-3-(1-乙丙氧基)-1-环己烯-1-羧酸乙酯磷酸盐结构式:
奥司他韦在2002年以商品名达菲进入我国市场,罗氏分别在2005年12月和2006年3月将奥司他韦的生产销售授权给了上海医药子公司和东阳光药,两家公司分别以商品名奥尔菲和可威上市销售,从此实现了奥司他韦的国产化。
获得专利授权后,东阳光药进行大规模投入对奥司他韦进行了生产工艺创新。目前东阳光药的可威拥有胶囊和颗粒剂两种剂型,其中颗粒剂是东阳光药的独家剂型,于2008年获批上市,并于2017年进入新版全国医保目录;其核心专利是CN1820744B,专利保护期至2026年,并拥有多个国家和地区的同族专利。
2012年后,东阳光药可威崛起,奥司他韦国内销售额实现爆发式增长。2018年可威颗粒和胶囊的销售额增长60.4%至22.47亿元,成为又一个国产20亿级的大品种,市场份额高达近九成。2019年上半年,可威销售收入达到29.33亿元,同比增长了116.5%,而东阳光药上半年总营收30.71亿元,可威占了超过95%。2020年1月2日公司发布的2019年度业绩预告显示,东阳光药全年总营业额为62.2亿元,同比剧增145%,这一增长主要还是由于核心产品可威销售额的持续增长。
美国FDA的审评标准向来是业界标杆,此次东阳光药的磷酸奥司他韦胶囊获取ANDA批文,将有助于产品的海外发展,有望凭借自身的高性价比打开“流感神药”奥司他韦的海外市场,也为东阳光药的业绩增长提供了新的支持。


美国联邦巡回上诉法院表示娇生公司 全球畅销精神分裂症药物的专利可能无效

注射用醋酸地加瑞克专利无效口审将于本月底进行

外观专利如何进行海外布局?










