
NEWS
最新消息
齐鲁制药安可达获批,国产生物类似药家族迎第三位成员
- 分类:最新消息
- 作者:华讯知识产权
- 来源:
- 发布时间:2020-01-21 19:50
- 访问量:
【概要描述】12月9日,齐鲁制药有限公司研制的贝伐珠单抗注射液(商品名:安可达)上市注册申请获得国家药品监督管理局批准。该药是国内首家以原研贝伐珠单抗为参照药、按照生物类似药途径研发和申报生产的产品,是国内获批的首个贝伐珠单抗生物类似药,主要用于晚期、转移性或复发性非小细胞肺癌、转移性结直肠癌患者的治疗。 这意味着齐鲁制药历时近10年科研攻关的重磅产品——重组抗VEGF人源化单克隆抗体注射液(商品名:安可达
齐鲁制药安可达获批,国产生物类似药家族迎第三位成员
【概要描述】12月9日,齐鲁制药有限公司研制的贝伐珠单抗注射液(商品名:安可达)上市注册申请获得国家药品监督管理局批准。该药是国内首家以原研贝伐珠单抗为参照药、按照生物类似药途径研发和申报生产的产品,是国内获批的首个贝伐珠单抗生物类似药,主要用于晚期、转移性或复发性非小细胞肺癌、转移性结直肠癌患者的治疗。 这意味着齐鲁制药历时近10年科研攻关的重磅产品——重组抗VEGF人源化单克隆抗体注射液(商品名:安可达
- 分类:最新消息
- 作者:华讯知识产权
- 来源:
- 发布时间:2020-01-21 19:50
- 访问量:
详情
12月9日,齐鲁制药有限公司研制的贝伐珠单抗注射液(商品名:安可达)上市注册申请获得国家药品监督管理局批准。该药是国内首家以原研贝伐珠单抗为参照药、按照生物类似药途径研发和申报生产的产品,是国内获批的首个贝伐珠单抗生物类似药,主要用于晚期、转移性或复发性非小细胞肺癌、转移性结直肠癌患者的治疗。
这意味着齐鲁制药历时近10年科研攻关的重磅产品——重组抗VEGF人源化单克隆抗体注射液(商品名:安可达)即将进入临床使用,将提高该类药品的可及性,为国内患者治疗提供了新的选择。
原研贝伐珠单抗(安维汀,Avastin)是一种人源化抗VEGF单克隆抗体,是罗氏旗下的全球首个可广泛用于多种瘤的抗血管生成药物,通过阻断VEGF而抑制肿瘤的血管新生,切断肿瘤区域的供血,抑制肿瘤的生长和转移,从而产生抗肿瘤作用。
该药于2004年首次获FDA批准,2005年在欧洲获批,2010年在中国上市用于治疗转移性结直肠癌,2015年又被NMPA批准用于治疗非小细胞肺癌。截止今日,获批包括结直肠癌、非小细胞肺癌、胶质母细胞瘤、肾细胞癌、宫颈癌、卵巢癌、输卵管癌、腹膜癌等多个实体瘤适应症。贝伐珠单抗的疗效和安全性已得到大量临床研究的证实,在多个瘤种中的应用,被国内外众多指南、诊疗规范纳入,并依据临床研究证据级别进行相应等级的推荐。
作为罗氏单抗三巨头之一,该药称霸销售榜多年,2018年全球市场销售额约为68.49亿瑞士法郎。Insight销售数据库显示,国内贝伐珠单抗2017年销售额约为15亿元。
贝伐珠单抗在中国的专利保护2018年到期,参与开发这样一个超级重磅品种的厂家日益增多,除首个获批的齐鲁制药是在2018年8月获得国家药品监督管理局药品审评中心受理承办之外,信达生物紧随其后于2019年1月提出上市申请获受理,目前共有12家企业处在临床III期,视为第二梯队;5家处于I期,视为第三梯队。
2017年国家医保谈判使得贝伐珠单抗的价格明显下调,从每瓶(100 mg/4 ml)5210元降为1998元,大大提高了可及性。未来随着国产生物类似物的陆续上市,中国肿瘤患者在贝伐珠单抗这一药物上的支付压力将会进一步减轻。
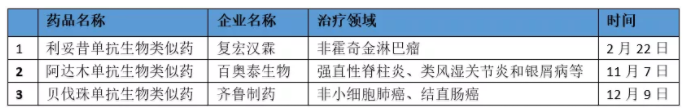
首款国产贝伐珠单抗生物类似药安可达成为了国产生物类似药家族的第三位成员。在其获批之后,2019年已有3款中国国产生物类似药获批,且均为重磅产品。它们分别是来自复宏汉霖的首款国产利妥昔单抗生物类似药;来自百奥泰生物的首款国产阿达木单抗生物类似药;以及来自齐鲁制药的首款国产贝伐珠单抗生物类似药。这是即将过去的这一年,中国生物医药产业在生物类似药研发领域取得的重大进展和突破。
生物类似药,是指在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品。通常,生物类似药上市被认为有助于提高生物药的可及性和降低价格,能够更好地满足公众对生物治疗产品的需求。
然而,由于生物药的研发和生产壁垒较高,在2019年之前中国尚未有国产生物类药获批上市。2015年2月,中国药品监管部门制订发布了《生物类似药研发与评价技术指导原则(试行)》。这为研发企业提供了方向,一部分中国医药研发企业快速布局生物类似药开发。
直至今年2月,中国首款生物类似药——由复宏汉霖研制的利妥昔单抗生物类似药的获批,使得该领域成功破冰。之后,百奥泰生物和齐鲁制药也各自拿下了重磅生物类似药的“首款”称号。值得一提的是,根据中国国家药监局早前公开数据,目前中国已成为生物类似药在研药物数量最多的国家,先后有近200余个生物类似药临床申请获得批准,且部分在研产品已完成3期临床,并提交了上市申请。
中国在2019年在生物类似药研发领域取得重大进展,这离不开中国一批生物医药企业和研发科学家们的努力,也离不开国家鼓励药械创新、鼓励生物类似物研发等政策的支持,以及近年来中国国家药监局在加快药品审评审批、解决药品可及性问题方面做出的努力。这些药物必将为患者带来新的治疗选择,也希望未来有更多新药好药为疾病治疗和人类健康发挥更大的能量。
关键词:

2024-04-19

美国联邦巡回上诉法院表示娇生公司 全球畅销精神分裂症药物的专利可能无效
2024-04-12

注射用醋酸地加瑞克专利无效口审将于本月底进行
2024-04-03

外观专利如何进行海外布局?
2024-03-29
上一页
1
2
...
184
下一页










