
NEWS
最新消息
肿瘤治疗新选择-中国首个选择性RET抑制剂 普拉替尼获批上市
- 分类:最新消息
- 作者:华讯知识产权
- 来源:
- 发布时间:2021-04-01 16:39
- 访问量:
【概要描述】近日,国家药品监督管理局批准普拉替尼(Pralsetinib)胶囊(商品名:普吉华)作为国家一类创新药上市申请,用于治疗既往接受过含铂化疗的转染重排基因(RET)融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。这是中国批准的首个选择性RET抑制剂。 RET是一个原癌基因,最早发现于1985年,定位于10号染色体,有21个外显子。RET所编码的RET蛋白是一种存在于细胞膜上的受体酪氨酸激酶(RTK),当生长因子与受体的胞外区域结合后就会触发一系列细胞内的链式化学反应,引起细胞的分裂、成熟并发挥相应功能。 随着研究的逐步进展,已发现多种疾病的发生与RET基因突变有关,其中RET基因融合在NSCLC患者中的发生率约为1%~2%,在甲状腺乳头状癌(PTC)中的发生率为10%,甲状腺髓样癌(MTC)中RET基因突变的发生率约为60%,其他发生RET变异的瘤种包括脑膜瘤、食管腺癌、乳腺癌、结直肠癌等。因此,RET基因变异成为“不限癌种”疗法的一个重要靶点。 近年来不断有针对RET融合的靶向药物在NSCLC患者中进行有效性和安全性的研究。其中普拉替尼是一种强效、高选择性的靶向致癌性RET变异的小分子激酶抑制剂,每日仅需服用一次,具有较好的依从性,被FDA授予治疗经含铂化疗后进展的RET融合阳性NSCLC以及需要系统治疗且没有可替代治疗方案的RET突变阳性甲状腺髓样癌的突破性疗法资格。 此外,基石药业在中国开展了全球ARROW研究的中国注册桥接试验,于2019年8月完成首例患者给药,同年12月完成了最后1例患者的入组。该项试验共纳入37例患者,中位年龄54岁(范围:26-77岁)。试验结果显示,接受普拉替尼治疗患者的总体缓解率(ORR)为56%,其中3%达到完全缓解(CR),疾病控制率(DCR)达到97%。截至2021年1月,中位治疗持续时间6.1个月(范围:0.9~9.4);18例缓解患者的首次缓解中位时间为1.9个月,其中89%(16/18)仍在接受治疗,中位缓解持续时间(DOR)尚未成熟,6个月的DOR率为83%。安全性方面,虽然10.8%的患者因不良事件停药,但未出现因普拉替尼治疗导致患者停药和死亡。 总体来说,普拉替尼在经含铂化疗的RET融合阳性NSCLC的中国患者中显示出了优越和持久的抗肿瘤活性,安全性及耐受性良好,未出现与普拉替尼相关的不良事件导致的治疗终止或死亡,为中国RET阳性肿瘤患者提供了一个新的治疗选择。 此次普拉替尼作为中国首个选择性RET抑制剂获批上市,将使更多的中国患者获益。
肿瘤治疗新选择-中国首个选择性RET抑制剂 普拉替尼获批上市
【概要描述】近日,国家药品监督管理局批准普拉替尼(Pralsetinib)胶囊(商品名:普吉华)作为国家一类创新药上市申请,用于治疗既往接受过含铂化疗的转染重排基因(RET)融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。这是中国批准的首个选择性RET抑制剂。
RET是一个原癌基因,最早发现于1985年,定位于10号染色体,有21个外显子。RET所编码的RET蛋白是一种存在于细胞膜上的受体酪氨酸激酶(RTK),当生长因子与受体的胞外区域结合后就会触发一系列细胞内的链式化学反应,引起细胞的分裂、成熟并发挥相应功能。
随着研究的逐步进展,已发现多种疾病的发生与RET基因突变有关,其中RET基因融合在NSCLC患者中的发生率约为1%~2%,在甲状腺乳头状癌(PTC)中的发生率为10%,甲状腺髓样癌(MTC)中RET基因突变的发生率约为60%,其他发生RET变异的瘤种包括脑膜瘤、食管腺癌、乳腺癌、结直肠癌等。因此,RET基因变异成为“不限癌种”疗法的一个重要靶点。
近年来不断有针对RET融合的靶向药物在NSCLC患者中进行有效性和安全性的研究。其中普拉替尼是一种强效、高选择性的靶向致癌性RET变异的小分子激酶抑制剂,每日仅需服用一次,具有较好的依从性,被FDA授予治疗经含铂化疗后进展的RET融合阳性NSCLC以及需要系统治疗且没有可替代治疗方案的RET突变阳性甲状腺髓样癌的突破性疗法资格。
此外,基石药业在中国开展了全球ARROW研究的中国注册桥接试验,于2019年8月完成首例患者给药,同年12月完成了最后1例患者的入组。该项试验共纳入37例患者,中位年龄54岁(范围:26-77岁)。试验结果显示,接受普拉替尼治疗患者的总体缓解率(ORR)为56%,其中3%达到完全缓解(CR),疾病控制率(DCR)达到97%。截至2021年1月,中位治疗持续时间6.1个月(范围:0.9~9.4);18例缓解患者的首次缓解中位时间为1.9个月,其中89%(16/18)仍在接受治疗,中位缓解持续时间(DOR)尚未成熟,6个月的DOR率为83%。安全性方面,虽然10.8%的患者因不良事件停药,但未出现因普拉替尼治疗导致患者停药和死亡。
总体来说,普拉替尼在经含铂化疗的RET融合阳性NSCLC的中国患者中显示出了优越和持久的抗肿瘤活性,安全性及耐受性良好,未出现与普拉替尼相关的不良事件导致的治疗终止或死亡,为中国RET阳性肿瘤患者提供了一个新的治疗选择。
此次普拉替尼作为中国首个选择性RET抑制剂获批上市,将使更多的中国患者获益。
- 分类:最新消息
- 作者:华讯知识产权
- 来源:
- 发布时间:2021-04-01 16:39
- 访问量:
近日,国家药品监督管理局批准普拉替尼(Pralsetinib)胶囊(商品名:普吉华)作为国家一类创新药上市申请,用于治疗既往接受过含铂化疗的转染重排基因(RET)融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。这是中国批准的首个选择性RET抑制剂。
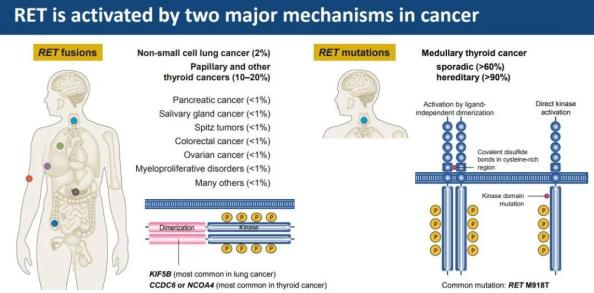
RET是一个原癌基因,最早发现于1985年,定位于10号染色体,有21个外显子。RET所编码的RET蛋白是一种存在于细胞膜上的受体酪氨酸激酶(RTK),当生长因子与受体的胞外区域结合后就会触发一系列细胞内的链式化学反应,引起细胞的分裂、成熟并发挥相应功能。
随着研究的逐步进展,已发现多种疾病的发生与RET基因突变有关,其中RET基因融合在NSCLC患者中的发生率约为1%~2%,在甲状腺乳头状癌(PTC)中的发生率为10%,甲状腺髓样癌(MTC)中RET基因突变的发生率约为60%,其他发生RET变异的瘤种包括脑膜瘤、食管腺癌、乳腺癌、结直肠癌等。因此,RET基因变异成为“不限癌种”疗法的一个重要靶点。
近年来不断有针对RET融合的靶向药物在NSCLC患者中进行有效性和安全性的研究。其中普拉替尼是一种强效、高选择性的靶向致癌性RET变异的小分子激酶抑制剂,每日仅需服用一次,具有较好的依从性,被FDA授予治疗经含铂化疗后进展的RET融合阳性NSCLC以及需要系统治疗且没有可替代治疗方案的RET突变阳性甲状腺髓样癌的突破性疗法资格。
此外,基石药业在中国开展了全球ARROW研究的中国注册桥接试验,于2019年8月完成首例患者给药,同年12月完成了最后1例患者的入组。该项试验共纳入37例患者,中位年龄54岁(范围:26-77岁)。试验结果显示,接受普拉替尼治疗患者的总体缓解率(ORR)为56%,其中3%达到完全缓解(CR),疾病控制率(DCR)达到97%。截至2021年1月,中位治疗持续时间6.1个月(范围:0.9~9.4);18例缓解患者的首次缓解中位时间为1.9个月,其中89%(16/18)仍在接受治疗,中位缓解持续时间(DOR)尚未成熟,6个月的DOR率为83%。安全性方面,虽然10.8%的患者因不良事件停药,但未出现因普拉替尼治疗导致患者停药和死亡。

总体来说,普拉替尼在经含铂化疗的RET融合阳性NSCLC的中国患者中显示出了优越和持久的抗肿瘤活性,安全性及耐受性良好,未出现与普拉替尼相关的不良事件导致的治疗终止或死亡,为中国RET阳性肿瘤患者提供了一个新的治疗选择。
此次普拉替尼作为中国首个选择性RET抑制剂获批上市,将使更多的中国患者获益。











